반응형
엔트로피 증가량 계산식
이상기체 (![]() )의 등엔트로피 과정의 엔트로피 변화
)의 등엔트로피 과정의 엔트로피 변화
열역학 1/2법칙과 단열 과정을 가정하면 엔트로피 변화량은 아래와 같이 구해진다.
![$\displaystyle \frac{P_2v_2^\gamma}{P_1 v_1^\gamma}=\left[Pv^\gamma\right]^2_1=e^{\Delta s/c_v}.$](https://web.mit.edu/16.unified/www/FALL/thermodynamics/notes/img576.png)
위 식에서 가역 과정 (![]() ) 을 가정하면
) 을 가정하면 ![]() 가 된다.
가 된다.
즉, 단열, 가역과정이 등엔트로피 (isentropic) 과정이다.
두 열원 사이의 열전달 과정의 엔트로피 변화
아래 그림과 같이 TH의 열원에서 TL열원으로 Q의 열량이 이동하는 과정에서 (일은 하지 않는다고 가정)
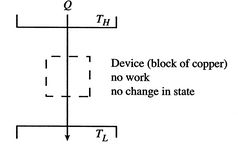
엔트로피 변화량은 TH열원 입장에서는 열이 -, TL 열원 입장에서는 열이 + 이다.
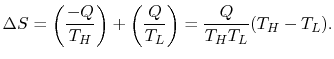
참고 문헌
https://web.mit.edu/16.unified/www/FALL/thermodynamics/notes/node41.html
반응형
'이론' 카테고리의 다른 글
| 디젤 싸이클 (Diesel cycle) (0) | 2020.06.25 |
|---|---|
| 오토 싸이클 (Otto Cycle) (0) | 2020.06.24 |
| 열역학 1법칙과 2법칙의 결합 (Gibb's equation) (0) | 2020.06.23 |
| 열역학 제2법칙 (2nd law of thermodynamics) (0) | 2020.06.23 |
| 카르노 싸이클 (Carnot cycle) (0) | 2020.06.16 |