열역학 제2법칙 (2nd law of thermodynamics)
고립된 계의 엔트로피는 감소하지 않는다는 법칙이다. 응?
우주를 고립계로 보고 결국 우주는 열평형 상태에 다다르고 일을 할 수 있는 에너지가 없어 멸망한다는 우주 멸망 예측의 무시무시한 법칙이다.
서술
열역학 제2법칙은 아래과 같이 설명되는데 모두 같은 얘기다. 읽어보면 너무 당연한 얘기이다.
켈빈-플랑크의 서술
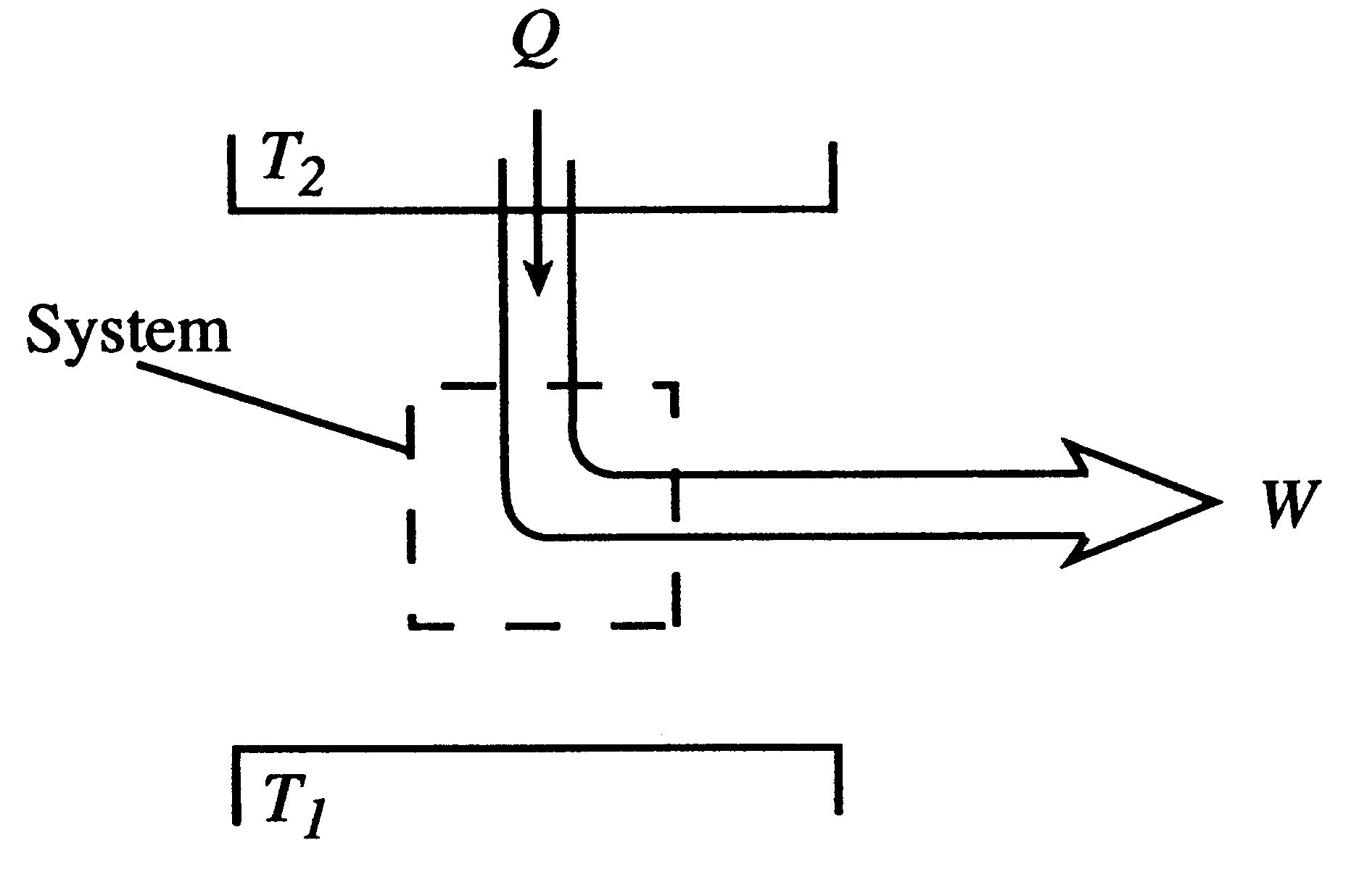
열을 모두 일로 바꾸는 과정은 불가능하다.
* 열효율이 100% 인 뜨거워지지 않는 엔진이 불가능하다.
* 아래 그림과 같은 과정이 불가능하다는 것이다. 즉 열의 일부는 T1 열원으로 가야한다는 것이다.
클라우지우스의 서술
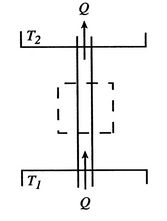
저온에서 고온으로는 열이 이동하는 것은 불가능하다.
* 아래 그림에서 T1 < T2 일 때, 아래와 같은 과정은 불가능하다.
엔트로피 (entropy)
열역학 제2법칙에서는 엔트로피라는 새로운 개념이 등장한다. 두둥
엔트로피는 시스템의 열역학적 특성 중의 하나로 가역 과정에서 다음과 같이 정의된다.
![]()
열역학 제2법칙은 아래와 같이 표현된다.
![]()
* 가역 과정일 경우에는 0이 된다.
엔트로피의 특성
시스템의 2개의 변수만 알면 구해질 수 있다. 예) ![]() 혹은
혹은 ![]() 혹은
혹은 ![]()
엔트로피 S의 단위는 J/K 이고 단위 질량당 엔트로피 s의 단위는 J/K-kg 이다.
엔트로피 변화량 식 ![]() 에서 Q는 온도가 높은 열원의 열량이며 T는 온도가 낮은 열원의 온도이다.
에서 Q는 온도가 높은 열원의 열량이며 T는 온도가 낮은 열원의 온도이다.
참고문헌
https://web.mit.edu/16.unified/www/FALL/thermodynamics/notes/node37.html
'이론' 카테고리의 다른 글
| 엔트로피 증가량 계산식 (0) | 2020.06.23 |
|---|---|
| 열역학 1법칙과 2법칙의 결합 (Gibb's equation) (0) | 2020.06.23 |
| 카르노 싸이클 (Carnot cycle) (0) | 2020.06.16 |
| 이상 기체의 단열 변화 (0) | 2020.06.16 |
| 정적 및 정압 비열 (0) | 2020.06.11 |