정적 및 정압 비열 (heat capacity)
열역학의 기본 개념 중 하나.
물질에 열을 가하면 온도가 상승하는데 물질에 따라 온도 상승량이 다르다. 이 때 필요한 열을 나타내는 것이 비열이다. heat capacity를 직역하면 열용량(=비열)이기 때문에 비열이 클수록 1도 올리기 위해 많은 열이 필요하다.
기체를 다룰 때에는 열을 가하는 과정에 따라 비열이 바뀌게 된다. 예를 들어 열을 가하는 과정에서 부피를 일정하게 한다든지 아니면 압력을 일정하게 한다든지에 따라 비열이 바뀌게 된다.
즉 기체의 비열은 물질뿐만 아니라 열을 가하는 과정에 따라 바뀌게 된다.
정적 비열의 정의
부피를 일정하게 유지하면서 (constant volume), 단위 질량의 물질을 단위 온도만큼 증가시키기 위한 열
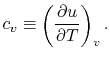
* 열역학 제1법칙의 수식으로 유도하면 위와 같은 수식이 나온다.
* ![]() 는 단위 질량에 대한 값이며
는 단위 질량에 대한 값이며 ![]() 는 1 mol에 대한 값으로 표현된다.
는 1 mol에 대한 값으로 표현된다.
정압 비열의 정의
압력을 일정하게 유지하면서 (constant pressure), 단위 질량의 물질을 단위 온도만큼 증가시키기 위한 열
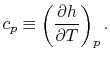
* 열역학 제1법칙의 수식으로 유도하면 위와 같은 수식이 나온다.
* ![]() 는 단위 질량에 대한 값이며
는 단위 질량에 대한 값이며 ![]() 는 1 mol에 대한 값으로 표현된다.
는 1 mol에 대한 값으로 표현된다.
이상 기체에서의 정적 및 정압 비열
- 이상 기체에서는
![]()
*![]() , 여기의 기체 상수 R은 아래 일반기체상수를 분자량으로 나눈 값이다.
, 여기의 기체 상수 R은 아래 일반기체상수를 분자량으로 나눈 값이다.
* 이상 기체의 상태방정식와 열역학 제1법칙을 적절히? 잘 사용하면 위 식이 유도된다.
![]()
* ![]() : 일반 기체 상수 (universal gas constant) = 8314 J/(kg K)
: 일반 기체 상수 (universal gas constant) = 8314 J/(kg K)
- 이상 기체에서는 비열비 (specific heat ratio) ![]() 는 항상 1보다 크다.
는 항상 1보다 크다.
- 이상 기체에서는 ![]() ,
, ![]() 는 온도 T 만의 함수이다.
는 온도 T 만의 함수이다.
참고문헌
https://web.mit.edu/16.unified/www/FALL/thermodynamics/notes/node18.html
'이론' 카테고리의 다른 글
| 카르노 싸이클 (Carnot cycle) (0) | 2020.06.16 |
|---|---|
| 이상 기체의 단열 변화 (0) | 2020.06.16 |
| 열역학 제1법칙 (1st law of thermodynamics) (0) | 2020.06.11 |
| 동력학의 기본이론과 질점의 운동학 (0) | 2020.05.07 |
| 유압 액추에이터의 종류 (0) | 2020.05.06 |